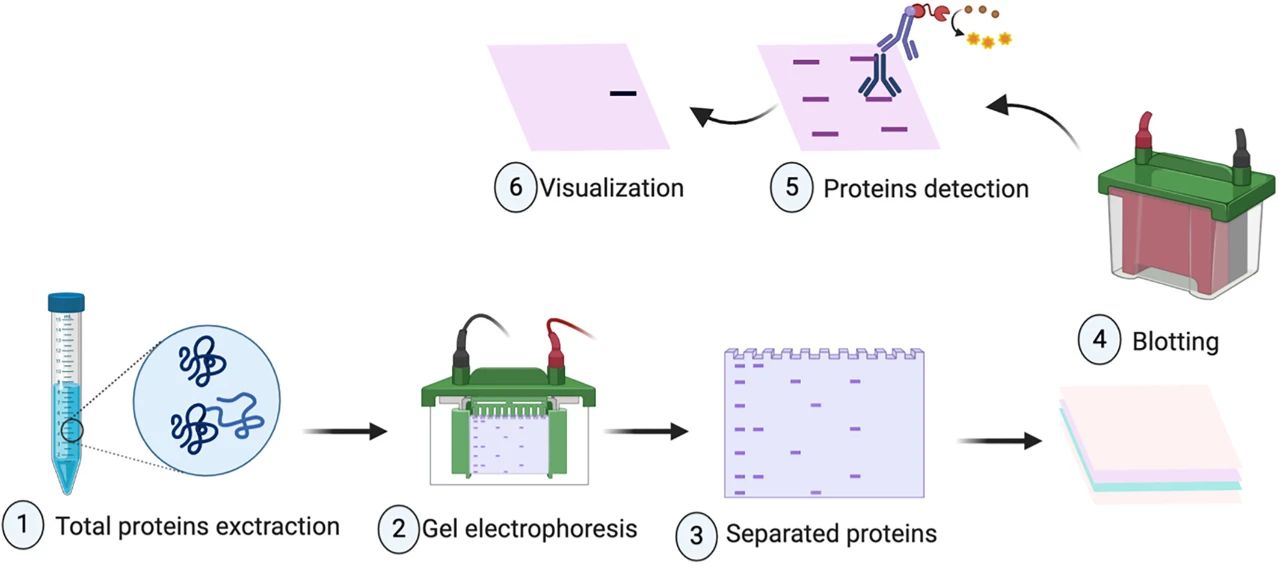
WB实验总结|显影条带异常分析&解决思路
7/9/2024 4:10:00 PM
问题一:
条带呈现波浪状,形似“八爪鱼”,丑丑不好看?

图1:改善前

图2:改善后
胶没凝固好或者制胶体系有问题?电流电压不稳?
问题二:
目的带背景深
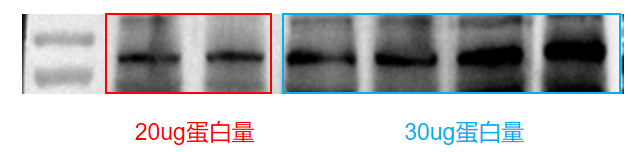
图1:20ug蛋白上样量与30ug蛋白上样量对比图
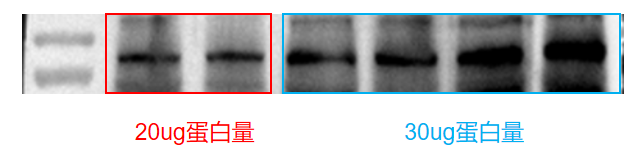

蛋白上样量大?洗膜不充分?封闭液(脱脂牛奶)浓度低,时间短?
-
20ug的蛋白上样量 -
.7.5%的脱脂牛奶室温封闭1h(改善前条件为:5%脱脂牛奶室温封闭1h;注:必要时也可延长封闭时间) -
PBST洗膜5次,每次5min,并加大了每次洗涤PBST的用量,7-8ml(改善前条件:洗膜3次,每次5min,PBST用量少,4ml左右)
最后成功实现显影条带降背景。
问题三:
隐约可见的目的带甚至无目的带?


蛋白表达低?抗体浓度太低或孵育时间太短?转膜失败?或许是二抗出现问题!
问题四:
显影出现黑斑,或者出现细沙样均匀的黑颗粒样物质,呈现磨砂玻璃样
本文作者是"夏沫梦鸢"同学,这篇文章是他精心汇总的关于Western blot最后一部显影操作中出现的4种条带异常的现象及解决方案。在获得他的授权后,实验老司机将本文发表于公众号。
文稿:夏沫梦鸢
校对:樊振华
素材:Canva
参考资料:
-
https://iubmb.onlinelibrary.wiley.com/doi/10.1002/bmb.21516 -
https://histogene.co/western-3/
