实验指南 I 流式细胞术实验常见问题分析
流式细胞技术(Flow Cytometry,简称FCM)是一种高效的方法,用于分析和收集细胞悬液中的单个细胞。FCM的优势在于其速度快、结果客观,并且具有重要的统计意义。它能够处理复杂的样本,同时收集多个参数,其可靠性和重复性都非常出色。
今天我将总结并分享一系列关于流式细胞技术的常见问题及其分析。对于流式细胞术的原理和步骤不甚清晰的同学,建议先阅读本公众号以往的文章,了解背景知识。
1.荧光抗体染色无信号或信号弱
(1)加入的抗体量不足:这是最简单的一种情况,只需要摸索实验条件,适当增加抗体的量或浓度。
(2)细胞数量过多:荧光弱可能是因为细胞相对于染料太多了,应该正确地调整细胞的密度,一般低于1*10^7个/ml。
(3)抗体储存方式不对:抗体没有保存在4℃并且避光,比如冷冻(-20℃甚至更低)保存可能会导致荧光抗体的沉降,显著影响抗体染色效果。
(4)用于细胞内染色的荧光染料分子量太大:染料体积太大,因此其进入细胞的可能性降低。
(5)一抗和二抗不相容:使用的二抗应与一抗的物种来源相同(例如,一抗为兔源,则应该使用抗兔源二抗)。
(6)仪器问题:(流式细胞仪的光学系统由三个部分组成:激光器、滤光片和检测器。激光器的数量、检测器的数量以及滤光器的类型共同决定仪器的检测范围)。这三部分之一出现问题的时候,就无法检测到荧光信号。
如滤光片选择有误:不同荧光有不同的发射谱,为了检测到信号,需要搭配能够捕捉到该波长信号的滤光片(滤光片可以将荧光激发后产生的相应波长的光子引导至特定的传感器上);激光器没有对齐:必要时通过运行液流检查微珠来调整路线。
(7)靶蛋白不存在/表达水平低:巧妇难为无米之炊,要给靶蛋白染色,至少要确保组织/细胞类型表达的靶蛋白至少处于足够检测的量。
(8)靶蛋白存在于细胞表面还是细胞内:有些抗原表达在细胞表面,有些表达在胞浆、细胞器内、胞核,甚至有些在所有部位都表达。比如对细胞系进行染色时,胰蛋白酶通常可以引起细胞表面蛋白的内化,因此需要确定好抗原的表达位置,选择合适的染色方法。
(9)靶蛋白的表达需要经过诱导:有些抗原在活化后发生下调,而有些蛋白则需要被诱导才能表达。因此要选择合适的方法激活细胞,使其充分表达靶蛋白,同时要加蛋白转运抑制剂使其留在胞内,然后固定破膜,染相应抗体。
(10)靶蛋白是分泌蛋白:分泌蛋白的检测十分困难,因为蛋白会在检测前从细胞中释放出来且可能快速降解。高尔基体阻断剂(如布雷非德菌素A)可用于抑制表达蛋白的分泌,使其仍保留在高尔基体中。然后再用细胞内染色法检测靶标蛋白。
(11)补偿过高:使用阳性对照再次正确设置流式细胞仪。
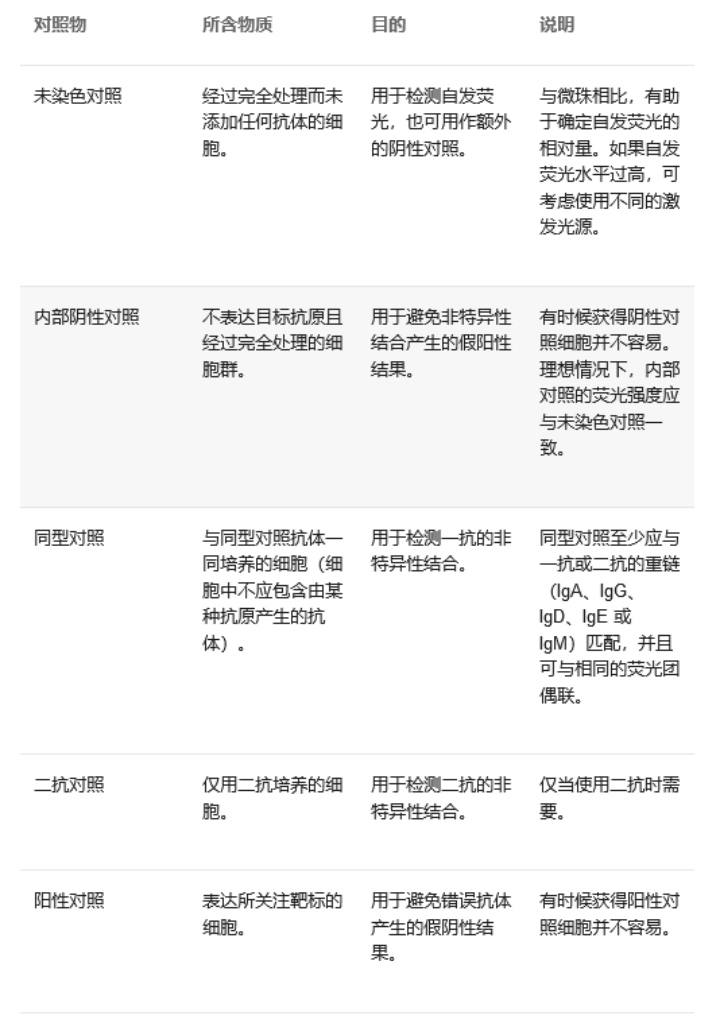
(abcam官网)
2.荧光强度过高
(1)抗体浓度过高:这将会导致非常明显的非特异性结合或者是特异性结合的高强度荧光。
(2)过多抗体被捕获于细胞内:在胞内染色的时候,较大的荧光分子被困在细胞内部。
(3)封闭不足:封闭这个操作可以有效地减少染料和蛋白的非特异性结合。
3.在应该只有一个细胞群的情况下观察到多个细胞群
(1)样品本身含有多个表达靶蛋白的细胞群:有可能是因为表达该靶蛋白的细胞群不止一个,但操作过程中没有做好分离。
(2)出现细胞双峰:出现了第一群两倍荧光强度的第二群细胞。可能是细胞分离不充分甚至是细胞团块没有过滤掉,导致检测时多个细胞聚集在一起。
4.仪器检测到的粒子太少
(这里的粒子指的是上样时仪器检测到的微粒,有可能是细胞,也有可能是破碎细胞产生的细胞器,或者没有充分分离而形成的细胞团块)
(1)细胞密度低:即每毫升样品的细胞数目太少,自然检测的效率就不高。
(2)检测的参数当中电压设置得太低。
(3)细胞聚集,堵塞管道:多个细胞聚集成团快,却被检测成一个粒子,且该粒子大小是异常的,在后续圈门也有可能被废弃。染色前要轻轻吹打几次,确保形成单细胞悬液,上样之前最好再次混匀。另外,染细胞死活对于这一问题也有帮助,因为死细胞会释放它的DNA,而DNA非常粘稠,最后会导致细胞成团。
5.背景高或阳性细胞百分比高
(1)抗体过量。
(2)补偿过低:流式细胞分析中经常要用到2种以上的荧光标记抗体进行染色,而目前所使用的多种荧光染料发射谱间有一定重叠,也就是说,荧光A的激发光会有一部分被荧光B的通道检测到,这就是荧光溢漏。例如,当我们在进行单色流式实验的时候,可以在其他通道砍到荧光信号,这些荧光信号就是溢漏出来的荧光,而纠正荧光溢漏的过程就是“补偿”。补偿太低,就无法正确地纠正这些溢漏的荧光信号,使背景变高。
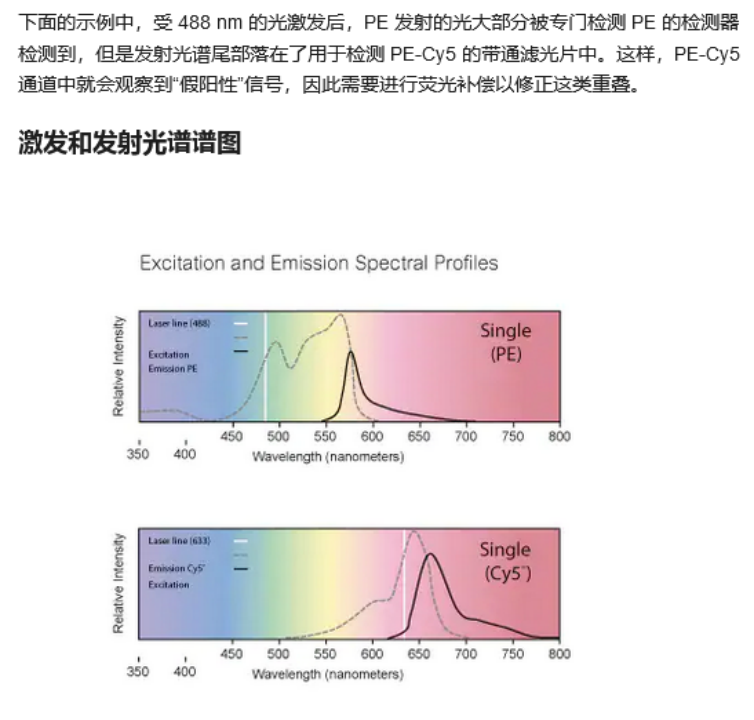
(abcam官网)
6.侧向散射(反映细胞的颗粒度)背景高
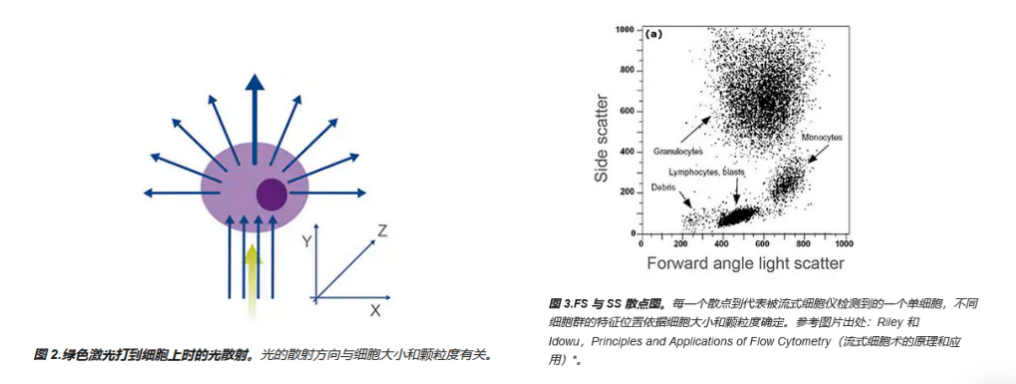
(abcam官网)
(1)细胞裂解过度:制备样品时离心或振荡过度,使细胞破碎产生细胞碎片。
(2)细菌污染:从其它微小颗粒和背景信号中区分细菌群落的最简单方法是用荧光染料标记细菌,然后使用该荧光来识别目标群落。
(3)死细胞的处理:流式细胞术非常容易被死细胞干扰,因为死细胞比活细胞更容易摄取抗体和探针,导致明显的非特异性染色。且死细胞的自发荧光往往特别强,这样背景荧光变强,就无法观察到一些靶蛋白的弱阳性表达了。
本文作者是"Algernon"同学,在获得授权后,实验老司机将本文发表于公众号和官网。
文稿:Algernon
校对:煲仔饭
参考资料:
-
https://www.azolifesciences.com/article/Antibodies-in-Flow-Cytometry.aspx
-
https://www.abcam.com/protocols/flow-cytometry-troubleshooting-tips-1
-
https://sciencefocus.hkust.edu.hk/flow-cytometry-sorting-cells-by-their-appearance
